再生障礙性貧血(AA)的發病機理十分復雜, 目前認為其發病主要與造血干細胞(HSC)量與 質的改變、骨髓造血微環境缺陷和免疫功能紊亂 有關。骨髓間充質干細胞(mesenchymal stem cell, MSC)是一種位于骨髓中具有自我更新、分化增殖 和多向分化潛能的干細胞。MSC 是骨髓造血微環境的重要組成部分,在造血調控中具有重要作用。
材料和方法
病例資料 本院 2016 年 7 月 - 2017 年 2 月確診再生障礙性 貧血患者 10 例;其中 4 例男性和 6 例女性,年齡 25±10 歲;同時招募 5 名健康供者,其中 4 名男 性和 1 名女性,年齡 31±15 歲作為對照,本研究 得到本院倫理委員會的批準,所有受試者均簽署 知情同意書。 試劑與儀器 骨髓間充質干細胞來源于本醫院知情同意的再 生障礙性貧血患者及健康供者;High DMEM 基 礎培養液購自中國 Hyclone 公司;FBS 購自美國 Gibco 公司;DAPT 購自日本 Sigma 公司;CCK8 試劑盒為中國碧云天公司產品;AnnexinV-FITC/ PI 試劑盒為中國南京凱基生物公司產品;細胞 周期檢測試劑盒為中國北京嘉美生物公司產品; PMSF 為美國 Amresco 公司產品;VEGF antibody 為美國 Affinity 公司產品;β-actin antibody 為英 國 Abcam 公司產品;油紅 O 為中國生工生物公 司產品;TRIZOL、RNA 溶解液均為中國全式金 公司產品;氯仿、異丙醇均為中國國藥集團化學 試劑有限公司產品;DEPC 為美國 Amresco 公司 產品;FITC 購自中國 Keygen 公司產品。低速離 心機購自中國上海貝恩生物科技有限公司;CO2 培養箱購自中國上海博訊公司;倒置顯微鏡為 日本 Olympus 公司產品;酶標儀為美國 Thermo Scientific 公司產品;流式細胞儀為美國 Becton Dickinson 公司產品;超凝膠成像儀為美國 BioRad 公司產品。 骨髓間充質干細胞(MSC)的分離及鑒定 從 AA 患者收集骨髓(BM)標本(5 ml),并從 健康供者收集正常 BM 標本。從 AA 患者的 BM 分 離 MSC。將 5 ml 骨髓與 DMEM(1︰1) 混 合 的 BM 樣品添加到淋巴細胞分離培養液(1.077 g/ml) 上,并通過離心機分離。將骨髓單核細胞重懸于DMEM 培養液中,并以 1×105 /ml 的密度接種于培 養瓶中。在 37 ℃、5% CO2、飽和溫度的培養箱中 培養 48 h 后更換培養液。培養 3-4 d 后,細胞生 長至 80%-90% 融合,消化,傳代,依次記為第 2、 第 3…代細胞。取第 3 代細胞進行流式細胞術檢測。 待融合達 80%-90% 時,用 2.5 g/L 胰蛋白酶消化 2-4 min,待 90% 左右細胞懸浮后用血清終止消化, 應用吸管仔細吹打使之形成細胞懸液。細胞懸液 經 100 目的濾篩過濾。離心后棄上清,用 PBS 制 成 2×105/ml 的細胞懸液,將細胞懸液分裝至 4 支 樣品管中。在 4 支樣品管中分別加入:FITC antihuman CD34、FITC anti-human CD44、FITC antihuman CD45、FITC anti-human CD90;混勻,4 ℃ 下避光反應過夜。棄上清,每管再加入 PBS 0.5ml 重新混懸細胞,用流式細胞儀檢測細胞表面抗原 CD34、CD90、CD44、CD45 的表達。 實驗分組 實驗分為 5 組:①正常 MSC 組:正常人的 MSC 于 DMEM 完全培養液中培養;② AA 組:AA 患者的 MSC 于 DMEM 完全培養液中培養;③ DAPT 組: AA 患者的 MSC 于含有 10 μmol/ LDAPT 的 DMEM 完全培養液中培養;④ VEGF 組:AA 患者的 MSC 于含有 100 ng/ml VEGF 的 DMEM 完全培養液中培 養;⑤ DAPT+VEGF 組:AA 患者的 MSC 于含 10 μmol/LDAPT 和 100 ng/ml VEGF 的 DMEM 完全培 養液中培養。 CCK8 檢測細胞增殖活性 通過細胞計數試劑盒 8 檢測不同組中 MSC 的增 殖能力。將 MSC 接種在 96 孔板(每孔 100μl) 中并在 37 ℃下用 5% CO2 培養直至完全粘附。用 DAPT 或 / 和 VEGF 處理 48 h 后,向每個孔中加入 10μl CCK8 溶液并孵育 2 h。通過酶標儀檢測 450 nm 處的光密度(OD)。 細胞凋亡和細胞周期檢測 采用流式細胞術檢測不同組 MSC 的凋亡和細胞周 期。用 DAPT 或 / 和 VEGF 處理 48 h 后,用 0.25% 胰蛋白酶消化 MSC。通過以 250 ×g 離心收集細 胞,并用冷磷酸鹽緩沖溶液(PBS)洗滌 2 次。然 后將這些細胞重懸于 300 μl 結合緩沖液中,并與 5 μl 膜聯蛋白 V- 熒光素異硫氰酸酯(FITC)在 室溫下黑暗中孵育 15 min。隨后在室溫下與 10 μl 碘化丙啶(PI)在黑暗中孵育 10 min,在流式細胞 儀上分析細胞凋亡。在檢測細胞周期中,將消化的 MSC 用 5 ml 70%冷乙醇在 4 ℃下固定過夜。用 冷 PBS 洗滌 2 次后,將這些細胞與 0.5 ml PI 在黑 暗中孵育 20 min,最后在流式細胞儀上分析細胞 在細胞周期中的分布。
結 果
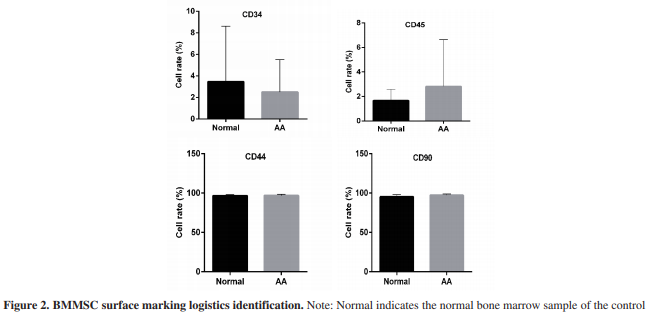
AA患者和健康供者 MSC的分離培養 圖1為 AA 患者骨髓 MSC 分離后 d 1 及分離培養 后 d 7 的圖像。圖 2 為骨髓間充質干細胞免疫表型細胞比例流式圖。由圖可見,正常組和 AA 組 MSC 細胞 CD34 和 CD45 均低表達。CD44 和 CD90 均高 表達,AA 組 CD44 和 CD90 表達略高于正常組,但 無顯著性差異(P > 0.05)。2 者細胞群體基本一致。 細胞增殖活性 CCK8 檢測結果顯示,與正常 MSC 組相比,AA 組 細胞OD值降低,說明細胞增殖降低。與AA組相比, 經過DAPT處理后,細胞OD值降低,細胞增殖降低; 經過 VEGF 處理后,細胞 OD 值增加,細胞增殖增 加;經過 DAPT 和 VEGF 聯合處理后,細胞增殖 高于 DAPT 單獨處理組,但低于 VEGF 處理組(圖 3)。結果提示,AA 患者細胞增殖弱于正常對照者細胞,VEGF 能改善 AA 引起的細胞增殖降低現 象。Notch 信號通路的抑制會加劇 AA 患者 MSC 的 增殖抑制。
討 論
再生障礙性貧血(AA)是一種臨床常見的血液系 統疾病,其臨床表現為全血細胞減少,繼發貧血、 出血、感染而危及患者生命 。造血干細胞(HSC) 移植和抗胸腺細胞球蛋白聯合環孢菌素 A 和雄激 素是 AA 的主要治療策略 [2,3] 。目前研究表明,骨 髓間充質干細胞(MSC)作為骨髓基質細胞的前體 細胞 , 是一類具有自我更新能力和具有免疫調節作 用的干細胞 , 是骨髓造血微環境的重要組成部分 , 其通過介導造血干細胞黏附 , 分泌多種細胞因子和 生長因子而發揮造血支持作用。據報道,MSC 在再生障礙性貧血細胞增殖,分化和造血方面具 有重要作用 , 并發現 CD106 在 MSC 通 過 NF-κB 在 AA 中發揮重要作用。MSC 可以通過調節幾乎 所有免疫細胞的功能來支持造血功能并維持免疫 穩態 。同時,AA 患者 MSC 表現出異常的基因表 達譜和異常的免疫學特性,表明 AA 患者的 MSC 功能異常 。然而,仍需要研究 MSC 對 AA 的分 子機制。
免責聲明:文章僅供學習和交流,如涉及作品版權問題需要我方刪除,請聯系我們,我們會在第一時間進行處理。